尽管在确定人类肝癌基因组改变方面付出了巨大的努力,但多组学数据的系统翻译仍然具有挑战性。
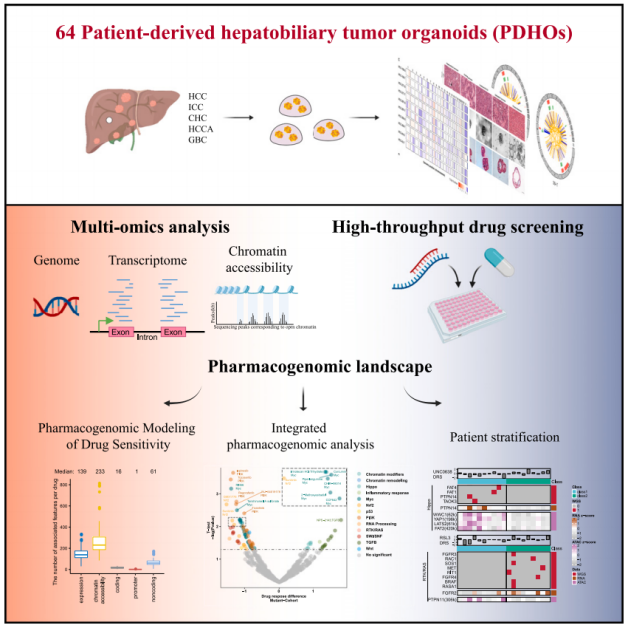
2024年1月25日,海军军医大学王红阳、陈磊、中国科学院分子细胞科学卓越创新中心高栋、 陈洛南及中国科学院数学与系统科学研究院王勇共同通讯在Cell Reports Medicine在线发表题为“Integrated characterization of hepatobiliary tumor organoids provides a potential landscape of pharmacogenomic interactions”的研究论文,该研究开发了一个准确预测肝胆肿瘤药物敏感性的研究模型—PDHO模型,该模型概括了肝胆肿瘤的关键特征,并有可能及时测试个性化治疗反应,并在肝胆肿瘤的基础和转化研究中得到广泛应用。
该研究观察到对265种代谢和表观遗传学相关化学物质和36种抗癌药物的不同反应。64种临床相关药物的全基因组、转录组、染色质可及性谱和药物敏感性结果的整合定义了超过32,000种基因组-药物相互作用。RUNX1启动子突变与染色质可及性增加和伴随的基因表达增加相关,促进了一系列对肝胆肿瘤优先敏感的药物。这些结果不仅提供了一个人类肝癌PDHO生物库的注释,而且为全面了解肝癌基因调控网络提供了一种系统的方法,促进了潜在的个性化医疗应用。
另外,2024年1月4日,海军军医大学王红阳院士/杨文研究员团队在Nature Communications 发表题为“TET2-mediated tumor cGAS triggers endothelial STING activation to regulate vasculature remodeling and anti-tumor immunity in liver cancer”的研究论文,该研究发现抑癌基因TET2通过肝癌细胞cGAS介导的血管内皮细胞STING激活,调控肿瘤血管重塑和抗肿瘤免疫的新机制,并提出采用大剂量维生素C激活TET2和cGAS来促进肝癌血管正常化和改善免疫治疗疗效的新策略。

肝胆肿瘤是全球癌症相关死亡的第四大原因,全球每年约有70万人死亡。肝胆肿瘤包括20多种不同的亚型,这些亚型在遗传、形态和临床上都存在差异。然而,只有一小部分患者从目前有限的治疗方案中受益。
最近的研究已经确定,在临床治疗反应的决定因素中,基因改变的获得改变了关键癌症基因的功能,例如,BRAF突变预测了对MEK抑制的敏感性新一代测序研究是对肝胆肿瘤肿瘤基因组的系统研究的最好例证,该研究绘制了全面的肝胆肿瘤分子图谱,并鉴定了40多个显著突变基因(SMGs),包括TP53、CTNNB1、AXIN1等关键基因位点。尽管有许多潜在的治疗靶点,但准确连接遗传特征与药物反应的能力有限,并不能准确指导临床治疗的肝胆肿瘤仍使其临床预后较差。
最近,三维类器官培养系统导致了新的和更生理的人类健康组织和癌症模型的发展。将组织来源的成体干细胞嵌入三维基质后,利用人工干细胞生态位环境,可以高效地生长为自组织的器官型结构自这一发现以来,类器官已被应用于模拟各种癌症,包括产生的肝胆肿瘤。尽管取得了这些进展,但人类肝胆类器官的多组学分析和大规模药物筛选尚未开展,这对将生物学行为与潜在临床结果联系起来构成了瓶颈。
机理模式图(图源自Cell Reports Medicine )
该研究在优化的培养基中直接从新鲜肿瘤标本中产生来自中国患者的患者源性肝胆肿瘤类器官(PDHOs)。建立了64个PDHOs系,并进行了全面的组织学、分子学、转录组学、基因组学和表观基因组学分析,结果表明所产生的PDHOs具有相应亲本肿瘤的肿瘤组织学和分子特征。
此外,对PDHOs的药物基因组学研究发现了未知的基因-药物关联,揭示了多组学整合和关键信号通路和分子通路改变之间的联系和一致性。
总之,这些结果突出了PDHO模型在基础研究和转化研究以及开发潜在的个性化治疗策略方面的潜在效用。
原文链接:https://doi.org/10.1016/j.xcrm.2023.101375













